技术支持Technical Support
联系我们CONTACT US
 400 179 0116
400 179 0116
24小时服务热线
黑素细胞的提取和培养Protocol
来源:启达生物 浏览量:1610 发布时间:2023-10-26
黑色素细胞是黑色素产生细胞,存在于皮肤、内耳、神经系统和心脏中(李,2014)。黑色素细胞及其前体细胞,即黑色素母细胞,起源于神经嵴细胞。了解黑素细胞的个体发生是发育生物学中的一个关键领域,对人类健康具有重要意义,与黑素细胞谱系细胞缺陷相关的大量人类疾病就是明证。那么黑素细胞怎么分离?
首先第一步准备好试剂:
黑素细胞,MM黑素细胞培养基(启达生物,货号:P5001),胰酶,PBS,FACS等
一、饲养层细胞培养:
1.将ST2细胞维持在ST2培养基中。处理来自T25组织培养瓶的细胞培养物的程序如下所述。所有步骤均在层流生物安全柜中无菌进行。
2.一旦ST2培养物达到80%汇合,通过抽吸去除生长培养基。
3.轻轻加入5 mL温热(37°C)无菌无Ca2+和无Mg2+的PBS,冲洗细胞单层并通过抽吸去除。
4.将细胞胰蛋白酶化,加入1mL 0.25%胰蛋白酶/EDTA溶液,并将细胞置于细胞培养箱中。
每隔2-4分钟通过相差显微镜检查细胞脱离的程度。
5.一旦约90%的细胞分离,加入7 mL温热(37°C)生长培养基使胰蛋白酶失活,并轻轻混合细胞悬浮液以产生单细胞悬浮液。
6.将1 mL细胞悬浮液转移到含有5 mL温热(37°C)生长培养基的新T25细胞培养瓶中。轻轻混合,将细胞放入培养箱中。
7.为了保持指数细胞增殖,每三天抽吸一次生长培养基,并用5mL新鲜生长培养基代替。不要让培养物达到80%以上的融合。

二、制备饲养层细胞
1.将在T25烧瓶中培养的ST2细胞胰蛋白酶消化后,将细胞悬浮液转移到15mL锥形管中。
2.将细胞在22°C下以200×g离心5分钟。吸取上清液,将细胞沉淀轻轻重悬于1 mL温热(37°C)RPMI生长培养基中。
3.使用血细胞仪测定细胞密度,并通过添加适当体积的温热RPMI生长培养基调节至70000个细胞/mL。
4.将100μL细胞悬浮液添加到放置在35mmμ皿中的4孔插入物的每个孔中(7000 ST2细胞/孔),并培养过夜。
注:使用光学级塑料的μ-培养皿可以实现高质量成像和最佳的细胞附着和扩散。
5.铺板后的第二天,在分离和纯化靶向黑色素母细胞(见下文)之前,通过抽吸去除ST2生长培养基。
6.向每个孔中加入100μL由黑素细胞生长培养基和ST2-RPMI生长培养基的1:1混合物组成的温暖(37°C)新鲜培养基。
7.将ST2饲养细胞放回培养箱中。
三、目的胚胎黑色素母细胞的分离
1. 单剂量IP给药他莫昔芬四天后(步骤B4),按照适当的机构批准的动物护理伦理程序,通过吸入二氧化碳或过量使用异氟烷,在15.5 dpc时对妊娠期母鼠实施安乐死。
2.将动物仰卧在吸收垫上,用70%乙醇浸泡胸部和腹部。
3.用钳子轻轻向外捏腹部中心以下的腹部皮肤,并用外科剪刀在中线上做一个小切口,确保不会切开腹腔。沿着腹部中线切开皮肤,轻轻地将皮肤拉向两侧,使其与下面的腹腔分离,从而露出子宫(图1)。
4.用钳子轻轻地将含有一串胚胎的子宫从体腔中取出。将子宫转移到含有无菌PBS的培养皿中,保持室温(22°C)。通过沿着子宫角在植入部位之间仔细切割来分离胚胎(图1)。
5.胚胎分离是在立体显微镜下进行的。为此,将单个胚胎和相关的子宫组织转移到另一个含有PBS的培养皿中。将胚胎保存在PBS中,用镊子从胚胎上剥离肌肉子宫层,然后去除蜕膜和胎盘外锥。
6.用钳子轻轻撕裂卵黄囊,轻轻撕裂脐带,使其与胚胎完全分离。
7.将胚胎转移到含有PBS的无菌组织培养皿中,并置于冰上。在这个阶段,可以去除胚胎尾部的一小段,并在必要时进行基因组DNA提取和基因分型处理(图1)
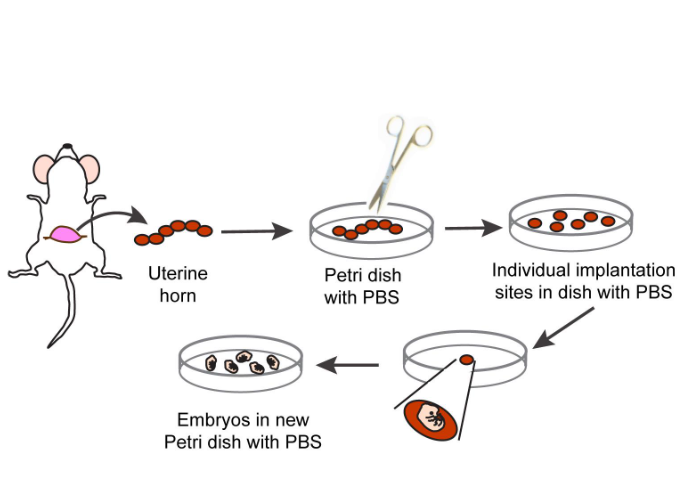
8.将胚胎转移到放置在立体显微镜台上的含有无菌PBS的培养皿中。
9.用钳子将胚胎保持在俯卧位,用手术刀在头部下方沿着中线轻轻地在整个胎体上做一个浅的纵向背侧切口,避免造成器官暴露的深切口。
10.使用剪刀,从最靠近颈部的切口点开始,轻轻地逐渐将皮肤与尸体分离。
注意:胚胎皮肤非常脆弱。用一把钳子通过胚胎的头部夹住胚胎,用另一把钳子轻轻地将皮肤与胎体分离。
11.将每个收获的皮肤漂浮在含有冰冷无菌PBS的无菌培养皿中。继续采集所有剩余胚胎的皮肤。
12.用镊子小心地将胚胎皮肤转移到无菌锥形管中,每个皮肤含有500μL无菌2.5%胰蛋白酶。
注:如果需要对单个胚胎进行分析,可以在含有500μL 2.5%胰蛋白酶的2mL微型试管中消化每个皮肤,然后切碎。
13.用小剪刀将皮肤切成约2毫米×2毫米的碎片,并在37°C下轻轻摇动孵育10分钟后,肉眼观察皮肤基本已经完成消化成絮状物,加入1mL胰蛋白酶中和溶液,轻轻混合。
14.通过40μm孔径的无菌细胞过滤器将细胞悬浮液过滤到15mL无菌锥形管中,以去除组织碎片。
15.为了获得单细胞悬浮液,将过滤的细胞混合物轻轻地通过装有21G针的5或10mL注射器10次,在22°C下以140×g离心5分钟。
16.通过抽吸小心地去除上清液,避免干扰细胞沉淀。
17.在300–500μL冰冷的FACS分选缓冲液中重新悬浮胚胎细胞。
注:在较大体积的FACS分选缓冲液中重新悬浮细胞将导致流速降低和分选时间增加,从而导致细胞活力降低。
18.将细胞悬浮液转移到5 mL BD Falcon玻璃管中,并置于冰上。
19.立即进行黑色素母细胞的细胞染色和FACS纯化。
20.将细胞分类到含有冰冷黑素细胞培养基的无菌管中。
21.在分选机中对分选的细胞悬浮液进行小份等分,用盖子密封含有剩余分选黑色素母细胞的试管,并将其输送到细胞培养房进行后续播种。
22.将分选的GFP阳性黑色素母细胞接种到含有先前制备的ST2饲养细胞融合单层的35mmμ-培养皿的插入孔中(D部分),并在37°C下培养。
注:每个胚胎获得的GFP阳性黑色素母细胞的平均数量约为500(范围从50到1400)。从4-8个胚胎中获得的黑色素母细胞可以合并到一个孔中。
23.分选16小时后,用移液管轻轻移走吸取的生长培养基,以避免干扰细胞单层,并用新鲜的生长培养液代替。
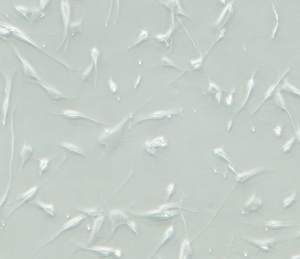
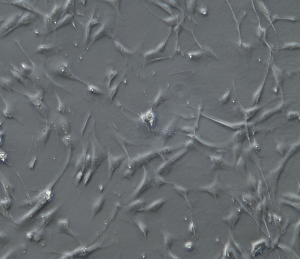
注:接种16小时后,约70%的黑色素母细胞将完全扩散并开始表现出树枝状(如下图)。
参考文献:
1.Abdallah, B. M., Alzahrani, A. M., Abdel-Moneim, A. M., Ditzel, N. and Kassem, M. (2019). A simple and reliable protocol for long-term culture of murine bone marrow stromal (mesenchymal) stem cells that retained their in vitro and in vivo stemness in long-term culture. Biol. Proced. Online 21(1): e1186/s12575-019-0091-3.
2.Adameyko, I., Lallemend, F., Aquino, J. B., Pereira, J. A., Topilko, P., Müller, T., Fritz, N., Beljajeva, A., Mochii, M., Liste, I., et al. (2009). Schwann Cell Precursors from Nerve Innervation Are a Cellular Origin of Melanocytes in Skin. Cell 139(2): 366–379.
3.Bosenberg, M., Muthusamy, V., Curley, D. P., Wang, Z., Hobbs, C., Nelson, B., Nogueira, C., Horner, J. W., DePinho, R., Chin, L., et al. (2006). Characterization of melanocyte-specific inducible Cre recombinase transgenic mice. genesis 44(5): 262–267.
4.Chevalier, C., Nicolas, J. F. and Petit, A. C. (2013). Preparation and Delivery of 4-Hydroxy-Tamoxifen for Clonal and Polyclonal Labeling of Cells of the Surface Ectoderm, Skin, and Hair Follicle. In: Turksen, K. (Ed.). Epidermal Cells (pp. 239–245). Methods in Molecular Biology. Springer, New York.
5.Crawford, M., Leclerc, V., Barr, K. and Dagnino, L. (2020). Essential Role for Integrin-Linked Kinase in Melanoblast Colonization of the Skin. J. Invest. Dermatol. 140(2): 425–434.e10.







