

一.MSC细胞成骨/成脂分化:
来源:启达生物 浏览量:2428 发布时间:2023-09-21
间充质干细胞(MSC)是来源于胚胎发育早期中胚层的一种具备自我更新、多向分化潜能且经体外规模化扩增仍能保持其生物学特性的成体干细胞,最早由Friedenstein等从骨髓中分离发现,具有贴壁性,呈纤维状,MSC具有来源丰富、制备简单、多向分化潜能、低免疫源性和低致瘤性等特点受到科研的亲睐,特别是MSC向成骨,成脂肪分化一直是实验制作的热点,MSC向成骨,成脂分化的操作步骤,记得收藏,实验用时不迷路。
准备材料:
1.MSC细胞(启达生物可提供人,大鼠,小鼠,新西兰大白兔,牛,猪来源MSC细胞,详见公司网站)
2. MSCM培养基(启达生物:P2001)
3. 诱导成骨分化培养基/Osteogenic differentiation medium(启达生物,货号:P1301)
4. 成脂分化培养基-adipogenic Culture Medium(启达生物,货号:P1302)
5. 24孔板



一.MSC细胞成骨/成脂分化:
在加入MSCM培养基的24孔板中,每孔板50000-60000个MSC细胞。
1.第二天或当它们达到汇合时(通常在24-48小时内),将培养基转换为分化培养基。若细胞太稀,则不会分化,因此在加入间充质干细胞分化培养基前必须确保MSC细胞至少80%-90%融合。
2.每2-3天换液,注意:成骨分化容易使细胞卷起,成骨分化时应使用包被液包被细胞培养板,可使用多聚赖氨酸溶液或者细胞包被液(货号:SD0044)进行细胞包被。
3.每隔1-2天更换新鲜的间充质干细胞分化培养基;
注意:换液时请注意,对24孔板要轻拿轻放,换液的培养基需要预热,换液时沿孔壁慢慢滴入,为防止成骨细胞脱落,建议成骨过程中出现大量钙结节之后,换液形式变为每天一次半量换液。
4. 诱导14-21天期间,视细胞的形态变化及生长情况进行染色。
二.细胞染色:
1.MSC诱导的成骨分化染色:
1.诱导成骨分化结束后,吸掉6孔板中的成骨分化培养基,用PBS冲洗1-2次。每孔加入1 mL细胞固定液,固定10~30 min;
2. 吸掉细胞固定液,PBS冲洗2次。每孔加入1 mL成骨检测染液,在室温下在黑暗中培养30分钟,并检查颜色发展
3.吸掉成骨检测染液,用PBS冲洗2-3次;
4.将培养板置于显微镜下观察成骨染色效果;
2.茜素红S染色检测矿化
茜素红S是一种钙敏感染料。分化的成骨细胞沉积大量的细胞外钙(矿化的标志),可以通过与茜素红S络合来检测。钙沉积呈现为亮橙红色染色区域,在对碱性磷酸酶染色的板拍照后,通过用1x PBS洗涤染色的板两次来进行茜素红S染色。
1.先PBS的pH值用0.1%NH4OH调节至4.2。
2.吸取PBS并加入足够的茜素红S染色溶液以覆盖细胞单层。将平板在室温下在黑暗中培养45分钟。
3.小心地吸取茜素红S溶液,用蒸馏水清洗板子四次。
4. 细胞外钙沉积物表现为颜色鲜艳的橙红色区域。
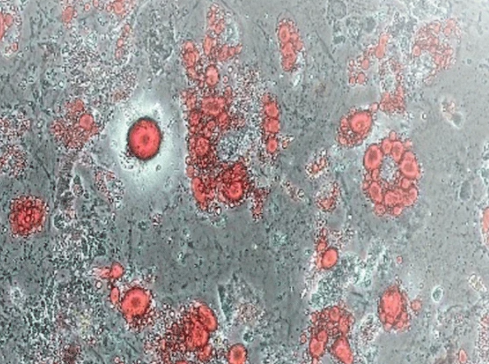
骨髓间充质干细胞诱导(Day12)
3.油红O染色法测定脂肪分化
这种染色测定基于亲脂性染料油红O保留在显微镜下可见的脂肪细胞脂肪球中的原理,操作步骤如下:
1.吸尽培养基并在PBS中洗涤细胞一次。
2.在室温下将细胞固定在4%PFA中15分钟。
3.用ddH2O洗涤两次,持续2 x 5分钟。
4.在室温下用Oil-Red-O工作溶液染色15分钟。
5.用1x PBS或ddH2O洗涤3 x 5分钟。
6.室温下用50%异丙醇冲洗细胞一次。
7.用1x PBS或ddH2O冲洗细胞。
8.红色染色的脂滴可以通过光学显微镜观察到。脂肪细胞也很容易在正常显微镜下通过其圆形形态和显著增强的较大脂滴的光反射来观察。
9.为了计数总细胞,用Mayer HemTox染色剂在RT下染色15分钟,并用dd水洗涤2次。
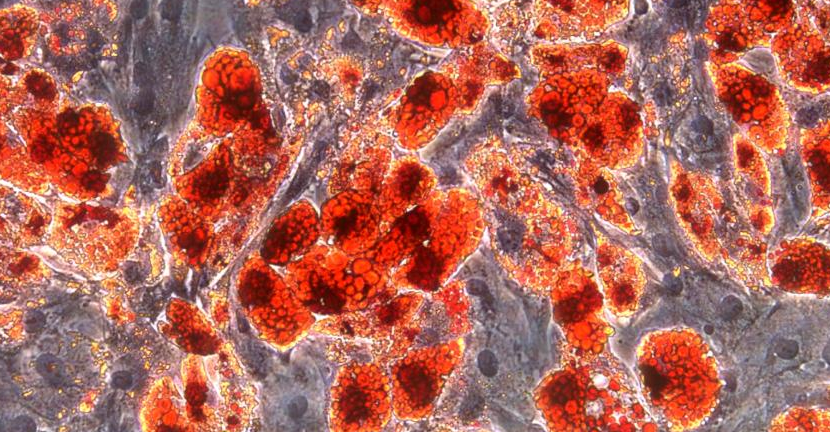
间充质干细胞脂肪诱导(Day10)